10月22日訊 《創(chuàng)新醫(yī)療器械特別審查程序》(后文簡稱“創(chuàng)新審批”)自2014年的試行版到2018年的修訂版,至今已正式實(shí)施了五年半的時(shí)間;《醫(yī)療器械優(yōu)先審批程序》(后文簡稱“優(yōu)先審批”)于2017年1月1日實(shí)施,也已走過近四年。
兩大程序是國家藥監(jiān)局基于鼓勵(lì)醫(yī)療器械研發(fā)創(chuàng)新以及滿足臨床急需等訴求開通的醫(yī)療器械審批“綠色通道”,通過優(yōu)先安排審查、加快審評審批效率等大大縮短產(chǎn)品上市時(shí)間,保證相應(yīng)產(chǎn)品和成果能盡快應(yīng)用于臨床,目前已經(jīng)取得了顯著成效。
一、總覽
截至2020年9月30日,國家藥監(jiān)局器械審評中心(CMDE)已公示了279個(gè)產(chǎn)品進(jìn)入創(chuàng)新審批,其中89個(gè)產(chǎn)品通過該通道獲批上市;已公示了44個(gè)產(chǎn)品進(jìn)入優(yōu)先審批,其中21個(gè)產(chǎn)品通過該通道獲批上市。
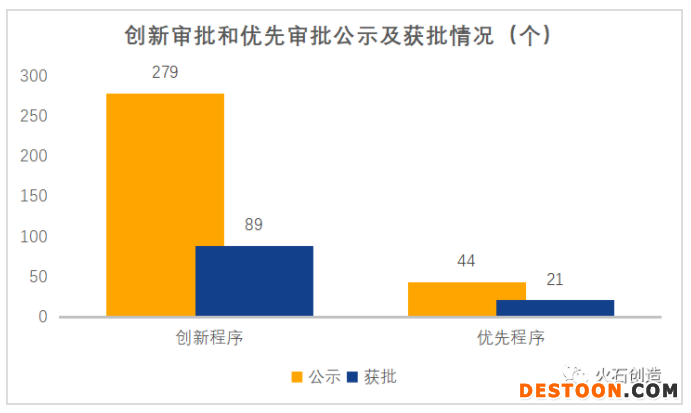
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
上市速度明顯加快,審批時(shí)間有望進(jìn)一步縮短。按照常規(guī)流程,二類醫(yī)療器械審批需花費(fèi)2年左右的時(shí)間,三類醫(yī)療器械則需花費(fèi)3年左右的時(shí)間。而據(jù)統(tǒng)計(jì),已通過創(chuàng)新審批上市的產(chǎn)品從公示到獲批上市平均用時(shí)682.5天,不到2年,最快的僅用時(shí)29天;通過優(yōu)先審批上市的產(chǎn)品平均用時(shí)386.5天,最快的僅用時(shí)103天,已大大縮短了上市時(shí)間。未來隨著經(jīng)驗(yàn)積累和流程優(yōu)化,審批時(shí)間有望進(jìn)一步縮短。
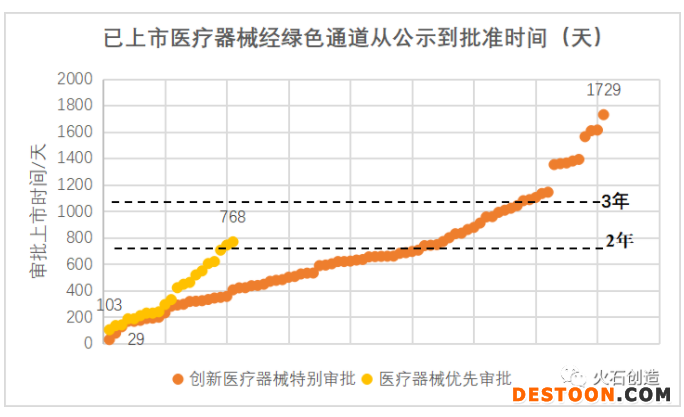
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
二、創(chuàng)新醫(yī)療器械特別審批
自2014年3月1日實(shí)施以來,創(chuàng)新審批每年公示和獲批的產(chǎn)品數(shù)量逐年增加,在2017年前后達(dá)到高峰,而2018年修訂后,開始出現(xiàn)下降趨勢。
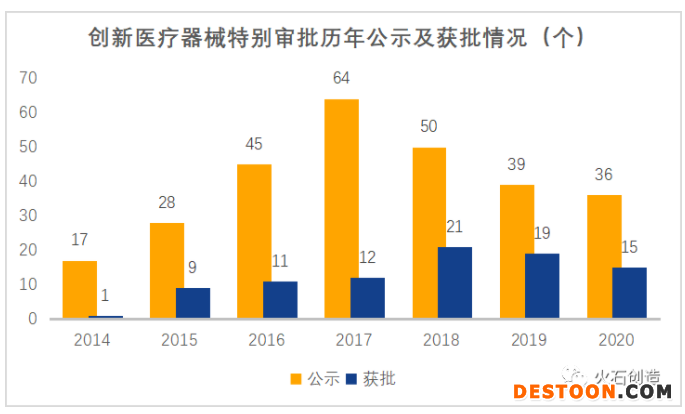
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
出現(xiàn)上述現(xiàn)狀的可能原因在于:1.審查程序的內(nèi)容和流程調(diào)整,導(dǎo)致適用情形、審批標(biāo)準(zhǔn)更加嚴(yán)格規(guī)范;2.程序開通以來,存量的具備國內(nèi)首創(chuàng)和全球領(lǐng)先水平的創(chuàng)新產(chǎn)品扎堆申請,而隨著創(chuàng)新審批的不斷進(jìn)行,具備條件的產(chǎn)品存量越來越少,使公示和獲批數(shù)量出現(xiàn)下降。這表明國產(chǎn)醫(yī)療器械產(chǎn)品創(chuàng)新后勁不足,企業(yè)創(chuàng)新投入還有待進(jìn)一步加強(qiáng)。
高值耗材占據(jù)半壁江山。從細(xì)分領(lǐng)域來看,創(chuàng)新審批公示產(chǎn)品中,心血管、骨科、眼科和牙科等高值耗材占比最大,接近50%,尤其是在基本實(shí)現(xiàn)進(jìn)口替代的血管支架領(lǐng)域,有眾多藥物洗脫支架、覆膜支架和可吸收支架進(jìn)入創(chuàng)新審批;其次是醫(yī)療設(shè)備(不含體外診斷設(shè)備),占比29%;體外診斷和軟件分別占比17%和4%。
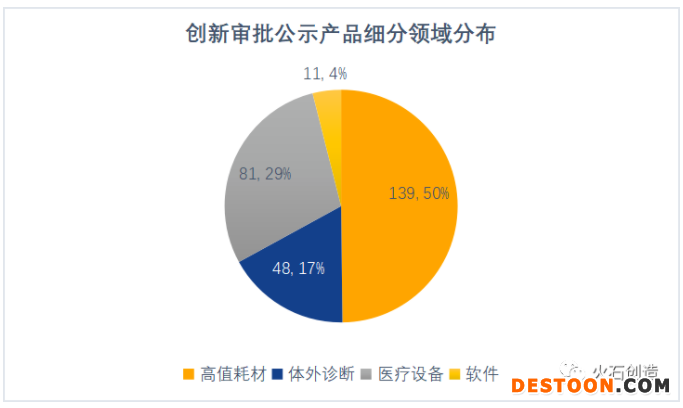
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
四大集聚區(qū)占比近九成。從地域分布來看,除35個(gè)進(jìn)口產(chǎn)品之外,長三角、珠三角、京津冀和川渝四大產(chǎn)業(yè)集聚區(qū)進(jìn)入創(chuàng)新審批公示的國產(chǎn)產(chǎn)品數(shù)量占了全國的近九成。
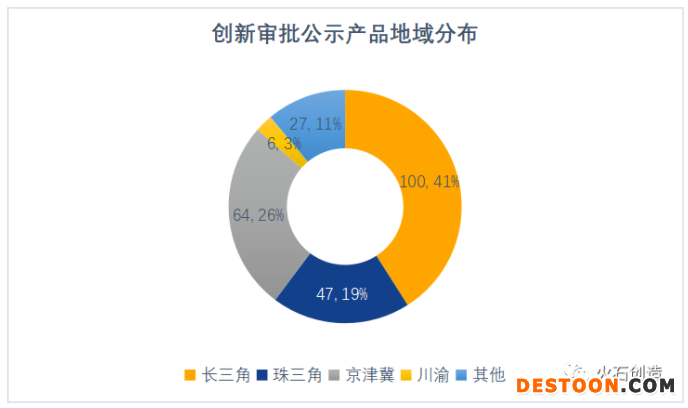
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
其中,北京(56個(gè))、廣東(47個(gè))、上海(46個(gè))、江蘇(36個(gè))、浙江(17個(gè))牢牢占據(jù)了公示數(shù)和獲批數(shù)的前五。
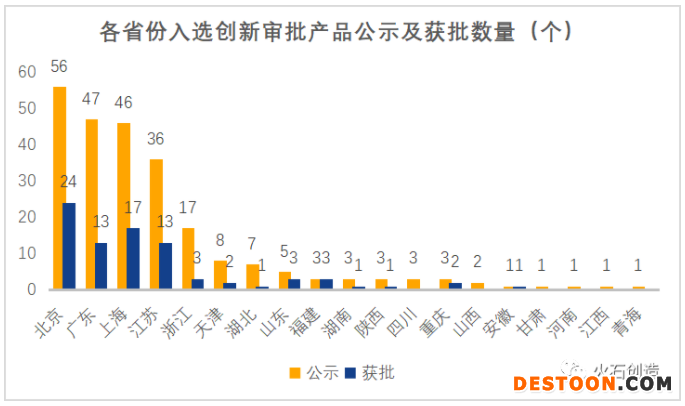
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
微創(chuàng)醫(yī)療和先健科技產(chǎn)品數(shù)領(lǐng)先。從單家企業(yè)納入創(chuàng)新審批的數(shù)量來看,微創(chuàng)醫(yī)療憑借旗下各業(yè)務(wù)線子公司的強(qiáng)勢表現(xiàn),成為納入創(chuàng)新審批和獲批上市產(chǎn)品數(shù)量最多的企業(yè),其中微創(chuàng)心脈、微創(chuàng)電生理、微創(chuàng)神通、微創(chuàng)醫(yī)療機(jī)器人均有多款產(chǎn)品進(jìn)入創(chuàng)新審批,并有7款產(chǎn)品先后經(jīng)該通道上市;先健科技也憑借9款產(chǎn)品進(jìn)入創(chuàng)新審批和2款產(chǎn)品成功上市,遙遙領(lǐng)先于國內(nèi)其他企業(yè)。此外,北京品馳、蘇州景昱、海杰亞等企業(yè)均有產(chǎn)品以系統(tǒng)產(chǎn)品申報(bào)創(chuàng)新,而需要套件或配件之間相互配合使用,因此以多個(gè)配件或套件形式同時(shí)獲批。
三、醫(yī)療器械優(yōu)先審批
自2017年1月1日實(shí)施以來,優(yōu)先審批以公示44個(gè)醫(yī)療器械產(chǎn)品,其中21個(gè)通過該通道獲批上市,占比接近50%。
國產(chǎn)占七成。優(yōu)先審批公示的產(chǎn)品中,國產(chǎn)產(chǎn)品30個(gè),占68.2%;進(jìn)口產(chǎn)品14個(gè),占全部公示產(chǎn)品的31.8%。與創(chuàng)新審批的甄選標(biāo)準(zhǔn)不同的是,優(yōu)先審批更加強(qiáng)調(diào)臨床需求,因此,其鼓勵(lì)國產(chǎn)創(chuàng)新的屬性相對較弱,這或許是優(yōu)先審批有更多進(jìn)口產(chǎn)品入選的一部分原因。
“列入國家重點(diǎn)研發(fā)計(jì)劃”成為最主要入選理由。優(yōu)先審批主要是為了加快“診斷或者治療罕見病、惡性腫瘤、老年人特有和多發(fā)疾病、專用于兒童、臨床急需等醫(yī)療器械,以及列入國家科技重大專項(xiàng)或國家重點(diǎn)研發(fā)計(jì)劃的”醫(yī)療器械審評審批,從公示產(chǎn)品入選理由來看,“列入國家重點(diǎn)研發(fā)計(jì)劃”成為目前最主要的入選理由,其次是“臨床急需”和“列入國家科技重大專項(xiàng)”。
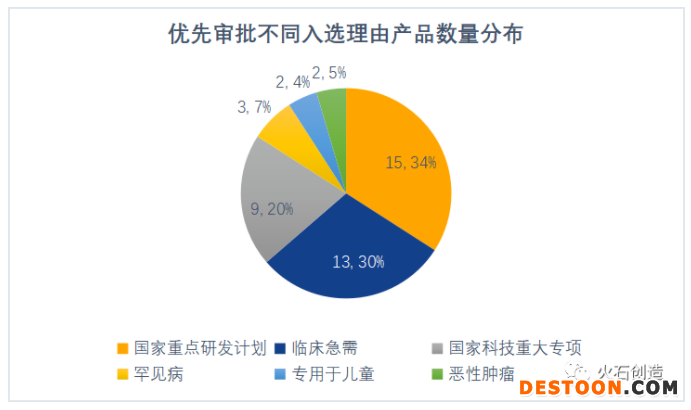
數(shù)據(jù)來源:火石創(chuàng)造整理自CMDE
創(chuàng)新審批和優(yōu)先審批兩大綠色通道明顯縮短了創(chuàng)新和臨床急需等醫(yī)療器械產(chǎn)品的上市時(shí)間,不但為解決臨床需求提供了極大幫助,也大大刺激了我國醫(yī)療器械企業(yè)研發(fā)創(chuàng)新的積極性。
注:本文數(shù)據(jù)均由火石創(chuàng)造整理自CMDE,按照注冊證編號計(jì)數(shù)(包含多個(gè)套件配合使用的系統(tǒng)類產(chǎn)品,每個(gè)套件對應(yīng)一個(gè)注冊證,因此一個(gè)產(chǎn)品可能對應(yīng)2-3個(gè)注冊證),統(tǒng)計(jì)截至2020年Q3。



 110102000668(1)號
110102000668(1)號