1月12日訊 2020年醫(yī)保目錄終于在2020年最后一周公布了!鑒于醫(yī)?;鹨呀?jīng)成為國(guó)內(nèi)醫(yī)藥市場(chǎng)的主要“買(mǎi)單者”,進(jìn)入醫(yī)保目錄是讓醫(yī)?;?ldquo;買(mǎi)單”的唯一路徑,研究醫(yī)保目錄的趨勢(shì)具備一定的意義。
那么,2020醫(yī)保目錄最終結(jié)果,帶來(lái)哪些風(fēng)向標(biāo)呢?
新目錄新變化
進(jìn)出之度
常規(guī)目錄和談判目錄
都按“年”動(dòng)態(tài)調(diào)整
2019年的醫(yī)保目錄調(diào)整有三大變化:一是重點(diǎn)監(jiān)控目錄藥品直接從醫(yī)保常規(guī)目錄踢出;二是醫(yī)保談判目錄產(chǎn)品可以轉(zhuǎn)入醫(yī)保常規(guī)目錄;三是上一年新獲批的批文有希望第二年就進(jìn)入醫(yī)保談判目錄。
2020年醫(yī)保目錄的調(diào)整,在2019年調(diào)整方向的基礎(chǔ)上又有新的變化。
過(guò)往以為,醫(yī)保談判目錄一年一變,醫(yī)保常規(guī)目錄是兩年一變。但是,從2020年醫(yī)保目錄的變化來(lái)看,醫(yī)保常規(guī)目錄和醫(yī)保談判目錄是按“年”動(dòng)態(tài)調(diào)整的。
廠家超2家產(chǎn)品
調(diào)入常規(guī)目錄的必要條件
通過(guò)醫(yī)保形式審查名單內(nèi)的產(chǎn)品直接調(diào)入醫(yī)保目錄共23個(gè),基本都是廠家數(shù)多于2家的產(chǎn)品。
有3個(gè)產(chǎn)品從2018年醫(yī)保談判目錄調(diào)入醫(yī)保常規(guī)目錄,分別是阿扎胞苷注射劑、阿法替尼口服常釋劑型和舒尼替尼口服常釋劑型,都是仿制藥廠家超過(guò)3家并且在國(guó)家藥品集中采購(gòu)目錄上的產(chǎn)品。
由此可見(jiàn),進(jìn)入醫(yī)保常規(guī)目錄的標(biāo)準(zhǔn)是生產(chǎn)廠家超過(guò)2家的產(chǎn)品。
同靶點(diǎn)同類產(chǎn)品難進(jìn)醫(yī)保
過(guò)期批文風(fēng)險(xiǎn)增大
除了調(diào)進(jìn)醫(yī)保常規(guī)目錄,還有產(chǎn)品被調(diào)出常規(guī)目錄,或不再是醫(yī)保目錄,或轉(zhuǎn)為醫(yī)保談判目錄。
根據(jù)2020年國(guó)家醫(yī)保藥品目錄調(diào)整工作方案,調(diào)出目錄藥品的范圍包括:1)被國(guó)家藥監(jiān)部門(mén)撤銷(xiāo)、吊銷(xiāo)或者注銷(xiāo)藥品批準(zhǔn)證明文件的藥品;2)綜合考慮臨床價(jià)值、不良反應(yīng)、藥物經(jīng)濟(jì)性等因素,經(jīng)評(píng)估認(rèn)為風(fēng)險(xiǎn)大于收益的藥品。
2020年醫(yī)保目錄共有29個(gè)藥品被調(diào)出醫(yī)保目錄,其中17個(gè)屬于已無(wú)批文的產(chǎn)品,剩下的產(chǎn)品基本上都是已在醫(yī)保目錄的同靶點(diǎn)同類藥品的可替代產(chǎn)品,或者是暫無(wú)廠家啟動(dòng)仿制藥一致性評(píng)價(jià)的產(chǎn)品。此前,這些藥品的過(guò)期批文曾被視為有并購(gòu)價(jià)值的,未來(lái)投資過(guò)期批文會(huì)有一定的風(fēng)險(xiǎn)。
常規(guī)目錄偏好多家生產(chǎn)品種
市場(chǎng)規(guī)模大的獨(dú)家產(chǎn)品轉(zhuǎn)入談判目錄
有12個(gè)產(chǎn)品從醫(yī)保常規(guī)目錄調(diào)到醫(yī)保談判目錄,這些產(chǎn)品都是銷(xiāo)售額排名前列的獨(dú)家產(chǎn)品,這些產(chǎn)品過(guò)往在醫(yī)藥采購(gòu)中具備議價(jià)權(quán),難以降價(jià)。本次降價(jià)進(jìn)入醫(yī)保談判目錄后可以繼續(xù)掛網(wǎng)采購(gòu),但是2年后又要繼續(xù)面臨醫(yī)保談判。暫時(shí)沒(méi)有產(chǎn)品進(jìn)入醫(yī)保談判目錄后被踢出醫(yī)保目錄,現(xiàn)有進(jìn)入醫(yī)保談判目錄后基本都是轉(zhuǎn)入醫(yī)保常規(guī)目錄。
由此看來(lái),未來(lái)醫(yī)保常規(guī)目錄多為生產(chǎn)廠家較多、價(jià)格有競(jìng)爭(zhēng)機(jī)制的產(chǎn)品,獨(dú)家產(chǎn)品有被談判轉(zhuǎn)去醫(yī)保談判目錄的風(fēng)險(xiǎn)。
同靶點(diǎn)/同機(jī)制產(chǎn)品競(jìng)爭(zhēng)
同價(jià)格下如何勝出?
進(jìn)入醫(yī)保的價(jià)格方面,同靶點(diǎn)/同作用機(jī)制的產(chǎn)品差價(jià)不會(huì)太大,雖然2020年醫(yī)保談判沒(méi)有同適應(yīng)癥的競(jìng)價(jià)模式。但是,只要該靶點(diǎn)/作用機(jī)制有一個(gè)標(biāo)桿的價(jià)格,同類產(chǎn)品也會(huì)陸續(xù)在醫(yī)保談判中降價(jià)的。
對(duì)于同靶點(diǎn)/同作用機(jī)制的不同通用名的新藥而言,只要競(jìng)爭(zhēng)者多,自然就會(huì)有企業(yè)愿意降價(jià)換市場(chǎng)。在研的有可能成藥的靶點(diǎn)本來(lái)就不多,同質(zhì)化競(jìng)爭(zhēng)是大趨勢(shì)。企業(yè)或許需要更多考慮的,不是醫(yī)保定價(jià)的問(wèn)題,而是在類似的價(jià)格下如何在同類競(jìng)品的競(jìng)爭(zhēng)中脫穎而出。
七條醫(yī)保通道
成功率PK
根據(jù)2020年8月國(guó)家醫(yī)療保障局關(guān)于公布《2020年國(guó)家醫(yī)保藥品目錄調(diào)整工作方案》和《2020年國(guó)家醫(yī)保藥品目錄調(diào)整申報(bào)指南》的公告,以及同年9月公示的《2020年國(guó)家醫(yī)保藥品目錄調(diào)整通過(guò)形式審查的申報(bào)藥品名單》的公告,醫(yī)保藥品目錄外的藥品納入2020年藥品目錄擬新增藥品范圍有七種情形(條件)。
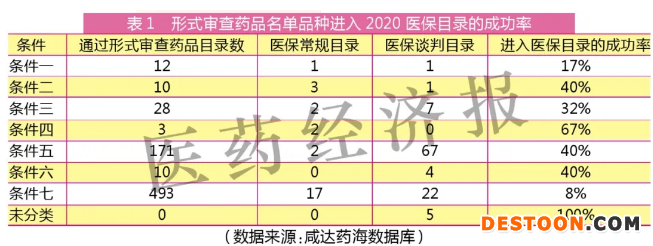
這七種情況進(jìn)入醫(yī)保目錄的最終結(jié)果又是怎樣的呢?
[路徑1] 臨床必需指南
成功率17%
根據(jù)《2020年國(guó)家醫(yī)保藥品目錄調(diào)整工作方案》,條件一為“與新冠肺炎相關(guān)的呼吸系統(tǒng)疾病治療用藥”。
通過(guò)形式審查的申報(bào)藥品名單中,符合這個(gè)條件的有12個(gè)產(chǎn)品。其中,只有2個(gè)產(chǎn)品能最終進(jìn)入醫(yī)保目錄,成功率不到20%。
由此來(lái)看,臨床必需的指南不一定是最終成為醫(yī)保目錄的關(guān)鍵。這從側(cè)面反映出,即使進(jìn)入了臨床必需的指南,也不一定會(huì)被醫(yī)保專家認(rèn)可。
[路徑2] 基藥目錄
成功率40%
條件二為“納入《國(guó)家基本藥物目錄(2018年版)》的藥品”。
2018年基藥目錄的藿香正氣合劑的“合劑”屬于口服液體劑,理論上早就在醫(yī)保目錄內(nèi),因此不能算新增產(chǎn)品。鑒于此,符合條件二的通過(guò)形式審查的藥品數(shù)本文統(tǒng)計(jì)為10個(gè)(而非公告的11個(gè))。
基藥目錄產(chǎn)品的不成功率高達(dá)60%,意味著通過(guò)形式審查的基藥產(chǎn)品有6個(gè)最終沒(méi)能進(jìn)入醫(yī)保。由此可知,進(jìn)入基藥目錄或許能拿到醫(yī)保目錄的預(yù)備門(mén)檻,但并不是必進(jìn)門(mén)檻。
不過(guò),鑒于未來(lái)進(jìn)入醫(yī)保目錄的方式越來(lái)越少,對(duì)于上市多年的產(chǎn)品而言,或許通過(guò)基藥目錄進(jìn)入醫(yī)保仍是可選擇的道路。
[路徑3] 鼓勵(lì)研發(fā)清單
成功率32%
條件三為“納入臨床急需境外新藥名單、鼓勵(lì)仿制藥品目錄或鼓勵(lì)研發(fā)申報(bào)兒童藥品清單,且于2020年8月17日(含,下同)前經(jīng)國(guó)家藥監(jiān)部門(mén)批準(zhǔn)上市的藥品”。
符合這個(gè)條件的通過(guò)形式審查藥品,僅32%進(jìn)入最終的醫(yī)保目錄。
一方面,可能是因?yàn)榧{入臨床急需境外新藥名單的產(chǎn)品價(jià)格非常貴,這些藥品不需要醫(yī)保都有患者購(gòu)買(mǎi),而這部分產(chǎn)品的高額價(jià)格又是“?;?rdquo;的醫(yī)保基金無(wú)力支付的。對(duì)于此類藥品,如何減輕患者的經(jīng)濟(jì)壓力,需要考慮別的救濟(jì)方式去解決。
另一方面,鼓勵(lì)仿制藥目錄或鼓勵(lì)研發(fā)申報(bào)兒童藥品清單作為優(yōu)先審評(píng)鼓勵(lì)的目錄,但實(shí)際獲批的產(chǎn)品很少。
此外,一些產(chǎn)品就算是鼓勵(lì)仿制,但其產(chǎn)品的適應(yīng)癥就決定了醫(yī)保目錄一般不會(huì)考慮納入,如西地那非和他達(dá)拉非。
[路徑4] 國(guó)家集采目錄
成功率67%(全部醫(yī)保常規(guī)目錄)
條件四為“第二批國(guó)家組織藥品集中采購(gòu)中選藥品”。
這是進(jìn)入常規(guī)醫(yī)保目錄成功率較高的條件,除了上文所提及的他達(dá)拉非,其余兩個(gè)產(chǎn)品都進(jìn)入了醫(yī)保常規(guī)目錄。鑒于本條件的廠家數(shù)都多于3家且已通過(guò)集中采購(gòu)具備價(jià)格,本條件的產(chǎn)品無(wú)一進(jìn)入醫(yī)保談判目錄。這意味著進(jìn)入了集中采購(gòu)的非醫(yī)保目錄的產(chǎn)品且具備中標(biāo)價(jià)格是進(jìn)入醫(yī)保常規(guī)目錄可能性較大的路徑。
[路徑5] 獲批上市新藥
成功率40%(97%醫(yī)保談判目錄)
條件五為“2015年1月1日至2020年8月17日期間,經(jīng)國(guó)家藥監(jiān)部門(mén)批準(zhǔn)上市的新通用名藥品”。
符合這個(gè)條件的通過(guò)形式審查新藥,進(jìn)入醫(yī)保的成功率為40%。新藥只有五年的機(jī)會(huì)進(jìn)入醫(yī)保,這和新藥保護(hù)的年限相當(dāng),這意味著2015年至2016年獲批的新通用名未來(lái)可能需要找其它路徑的方式進(jìn)入醫(yī)保。
國(guó)產(chǎn)PD-1全部選擇進(jìn)入醫(yī)保目錄反映出,只要同類同靶點(diǎn)/作用機(jī)制產(chǎn)品有一個(gè)進(jìn)入醫(yī)保談判目錄并且獲得不錯(cuò)的成績(jī),將會(huì)促進(jìn)其它競(jìng)爭(zhēng)產(chǎn)品進(jìn)入醫(yī)保,并且以第一個(gè)進(jìn)入產(chǎn)品的價(jià)格作為基石。
[路徑6] 增加適應(yīng)癥
成功率40%(全部醫(yī)保談判目錄)
條件六為“2015年1月1日至2020年8月17日期間,根據(jù)臨床試驗(yàn)結(jié)果向國(guó)家藥監(jiān)部門(mén)補(bǔ)充申請(qǐng)并獲得批準(zhǔn),適應(yīng)癥、功能主治等發(fā)生重大變化的藥品”。
符合條件六的通過(guò)形式審查藥品,有40%能進(jìn)入醫(yī)保談判目錄,沒(méi)有產(chǎn)品能直接進(jìn)入醫(yī)保常規(guī)目錄。不過(guò),對(duì)于上市多年的產(chǎn)品來(lái)說(shuō),增加適應(yīng)癥可能仍是為數(shù)不多的進(jìn)入醫(yī)保的路徑。
[路徑7] 省增補(bǔ)醫(yī)保目錄
成功率8%
條件七為“2019年12月31日前,進(jìn)入5個(gè)(含)以上省級(jí)最新版基本醫(yī)保藥品目錄的藥品。其中,主要活性成分被列入《第一批國(guó)家重點(diǎn)監(jiān)控合理用藥藥品目錄(化藥及生物制品)》的除外”。
這是最多產(chǎn)品進(jìn)入通過(guò)形式審查藥品名單的分類,但進(jìn)入醫(yī)保目錄的成功率卻最低,僅8%最終成為醫(yī)保目錄產(chǎn)品。
2019年醫(yī)保目錄不允許各省增補(bǔ)目錄并且要求各省在3年內(nèi)清退目錄,2020年醫(yī)保局提出條件七給這些省增補(bǔ)醫(yī)保目錄的產(chǎn)品一次進(jìn)入國(guó)家醫(yī)保的機(jī)會(huì)。但是,依然有454個(gè)產(chǎn)品沒(méi)能通過(guò)這次機(jī)會(huì)進(jìn)入醫(yī)保目錄。目前暫不知道條件七這一政策是否延續(xù)到2022年這個(gè)最后清退年份。



