3月9日訊 澤布替尼是中國首個獲得FDA突破性療法認(rèn)定、首個在美國獲批的本土研發(fā)抗癌新藥。繼先后在美國、中國獲批后,近日該藥又傳出好消息,阿聯(lián)酋、加拿大均批準(zhǔn)了澤布替尼的新藥上市申請,分別用于治療復(fù)發(fā)難治型套細(xì)胞淋巴瘤(MCL),以及治療華氏巨球蛋白血癥(WM)。
接連拿下美國、中國、阿聯(lián)酋和加拿大的上市許可,澤布替尼“出海”步履不停,這也證明“讓中國新藥走出國門”的理想不是癡人說夢,而是切實(shí)可行的目標(biāo)。澤布替尼的成績除了與百濟(jì)神州自身多年的耕耘布局密不可分,也離不開時代賦予的機(jī)會。
特別是最近5年多來,在政策鼓勵、資本加持、人才回流、技術(shù)推動的多重利好下,中國創(chuàng)新藥產(chǎn)業(yè)的發(fā)展達(dá)到新高度,國內(nèi)制藥企業(yè)正以前所未有的速度發(fā)展迭代。藥物研發(fā)的創(chuàng)新內(nèi)涵也從me too 、fast follow向me better/best、first in class層層推進(jìn),與海外公司之間開展項(xiàng)目合作也出現(xiàn)了license in與license out交相輝映的大好局面。隨著“立足中國、面向全球”成為越來越多本土創(chuàng)新藥企業(yè)的發(fā)展愿景,“自主開發(fā)+授權(quán)合作”也隨之成為了創(chuàng)新藥國際化的重要戰(zhàn)略。
01 中國創(chuàng)新藥國際化穩(wěn)步推進(jìn)
2019年之前,沒有一個中國企業(yè)自主開發(fā)的創(chuàng)新藥登陸國際市場。即便是早期的臨床注冊及試驗(yàn)研究,選擇去歐美同步開發(fā)的中國藥企亦是寥寥無幾。公開資料顯示,最早在中美兩國申報新藥臨床研究的品種是磷酸瑞格列汀,由恒瑞醫(yī)藥于2009年向FDA提出臨床研究申請并獲得批準(zhǔn)。
得益于中國藥品審評審批制度改革的提速,尤其是2017年中國成為國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH)正式會員之后,本土藥企積極開拓國際市場,創(chuàng)新藥的中美雙報和同步開發(fā)成為焦點(diǎn)。越來越多中國企業(yè)向FDA遞交臨床研究申請材料。
據(jù)不完全統(tǒng)計,2017年之后中美雙報的臨床獲批數(shù)量較2017年前翻了近10倍。且最近兩三年已有數(shù)家本土藥企開始嘗試國際多中心臨床研究。以澤布替尼為代表的中國創(chuàng)新藥產(chǎn)品國際化注冊穩(wěn)步推進(jìn)就是其中一個典型。
公開資料顯示,澤布替尼在全球開展了近30項(xiàng)臨床試驗(yàn),包括超過20項(xiàng)全球性臨床試驗(yàn),其中用于美國申報的數(shù)據(jù)之一就來自一項(xiàng)開放性、多中心的I/II期臨床試驗(yàn)AU003研究。截至2021年1月,澤布替尼的入組患者超過3100名,其中超過2400名患者來自海外。
與此同時,澤布替尼除了已經(jīng)獲批的四個國家外,還在全球遞交了超過20項(xiàng)相關(guān)上市申請,涵蓋五大洲40多個國家和地區(qū)。憑借良好的臨床數(shù)據(jù)表現(xiàn),澤布替尼在FDA批準(zhǔn)之前就曾多次獲得FDA授予的“孤兒藥”資格,以及“快速通道”、“突破性療法”、“優(yōu)先審評”等資格認(rèn)定。
除了中美雙報數(shù)量不斷激增,近年來中國藥企也加大了向FDA尋求孤兒藥資格認(rèn)定的申請力度。早在2016年,澤布替尼先后獲得FDA授予的3項(xiàng)孤兒藥資格認(rèn)定,分別用于治療套細(xì)胞淋巴瘤、華氏巨球蛋白血癥和慢性淋巴細(xì)胞白血病。
中國藥企獲FDA孤兒藥認(rèn)定數(shù)量
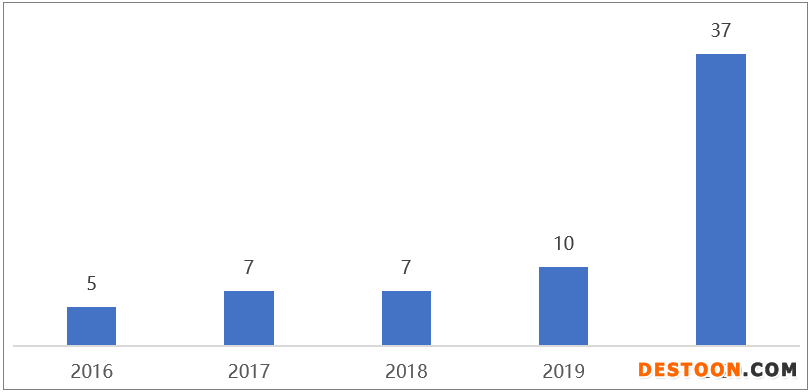
從2014年至今,中國藥企拿下了70多個孤兒藥資格認(rèn)定,并且其數(shù)量呈井噴式增長。尤其是2020年共有19家中國公司獲得35項(xiàng)FDA孤兒藥資格,亞盛醫(yī)藥憑借4款藥物囊獲8項(xiàng)孤兒藥資格認(rèn)定成為最大贏家;百濟(jì)神州、君實(shí)生物則分別以4項(xiàng)和3項(xiàng)認(rèn)定位居其后。
突破性療法認(rèn)定通道由FDA于2012年設(shè)立,旨在加快用于治療嚴(yán)重疾病、并在早期臨床研發(fā)階段展現(xiàn)良好療效的藥品的開發(fā)和注冊流程。獲得突破性療法認(rèn)定一般意味著這個藥物有較高的創(chuàng)新水平,未來也極有可能會給某個疾病的臨床治療實(shí)踐帶來重大變革。
2019年1月,F(xiàn)DA授予澤布替尼突破性療法認(rèn)定,這是FDA首次對中國新藥授予該資格。這項(xiàng)認(rèn)定的授予,標(biāo)志著中國新藥在走向全球的進(jìn)程中邁出重要一步。至今,已經(jīng)有7個中國創(chuàng)新藥拿到FDA的突破性療法資格。
獲得FDA突破性療法認(rèn)定的中國創(chuàng)新藥

注:xevinapant最早是由亞盛醫(yī)藥的前身亞生公司開發(fā),2011年轉(zhuǎn)讓給了Debiopharma,德國默克3月1日以8.98億歐元引進(jìn)該藥的全球權(quán)益
一直以來, FDA的批準(zhǔn)被視為全球通行證,國際上很多藥企都以追求獲得FDA認(rèn)可作為產(chǎn)品品質(zhì)的最高榮譽(yù)和保證。中國創(chuàng)新藥想走出去,想要進(jìn)軍國際市場,去海外開展臨床試驗(yàn)、獲得海外監(jiān)管機(jī)構(gòu)認(rèn)可,是其中關(guān)鍵的一步。
澳大利亞藥物管理局(TGA)對于臨床前要求采取備案制,只要在動物實(shí)驗(yàn)上的數(shù)據(jù)不錯,即便有些數(shù)據(jù)還不夠完整不能達(dá)到FDA的要求,藥企去TGA申報亦可先啟動項(xiàng)目。此外,澳大利亞還有超過40%的研發(fā)費(fèi)用退還,可以減輕藥企的研發(fā)負(fù)擔(dān)。
對于一些腫瘤免疫療法,動物實(shí)驗(yàn)數(shù)據(jù)很難起到較好的預(yù)測和借鑒意義,如果能越早進(jìn)入到人體試驗(yàn),對產(chǎn)品的后續(xù)開發(fā)越能起到積極作用。
為縮短藥品上市時間,降低開發(fā)成本,不少中國創(chuàng)新藥企闖蕩海外臨床試驗(yàn)過程中,將“首秀”選擇在了澳大利亞。它們將在澳大利亞獲得的I期臨床試驗(yàn)數(shù)據(jù)呈現(xiàn)給日本、美國甚至中國等國家的監(jiān)管機(jī)構(gòu),以實(shí)現(xiàn)滾動開發(fā),提高效率。
2014年8月,澤布替尼在澳大利亞啟動首個人體臨床試驗(yàn),并以此數(shù)據(jù)進(jìn)行中美雙報,加快在中美開展確證性試驗(yàn)的步伐。百濟(jì)神州高級副總裁、全球藥政事務(wù)負(fù)責(zé)人閆小軍曾介紹,在澤布替尼臨床試驗(yàn)的早期,百濟(jì)神州團(tuán)隊(duì)提出創(chuàng)新的策略,通過澳大利亞的I期臨床資料,支持了中、美的II期臨床和關(guān)鍵臨床試驗(yàn),后期通過中國的關(guān)鍵II期臨床試驗(yàn)數(shù)據(jù),又進(jìn)一步支持了美國、中國,以及后續(xù)多個國家的上市申請和批準(zhǔn)。
去海外開展新藥臨床試驗(yàn),也正在中國創(chuàng)新藥企中成為潮流。除了百濟(jì)神州外,還有君實(shí)生物、康寧杰瑞、基石藥業(yè)、復(fù)宏漢霖等諸多藥企躍躍欲試,相繼在海外啟動了臨床試驗(yàn)。
總體而言,借用不同國家/地區(qū)政策紅利開展的國際多中心臨床研究,既可以利用低成本敲開國外市場大門,又能隨著其上市地域和適應(yīng)癥覆蓋范圍的不斷擴(kuò)大,降低產(chǎn)品邊際成本,從而以更為親民的價格服務(wù)患者。
而在中國,澤布替尼于2020年6月獲得NMPA批準(zhǔn),半年后即以降價超過40%被納入國家醫(yī)保。隨著2021年3月1日新版國家醫(yī)保目錄的正式執(zhí)行,澤布替尼在國內(nèi)從每盒(64粒/盒)11300元的上市價格降到了6336元的醫(yī)保價。如若結(jié)合各地的報銷比例,患者每月自付費(fèi)用還將在此基礎(chǔ)上進(jìn)一步降低約60%~90%不等,極大地減輕了患者的治療負(fù)擔(dān),讓國內(nèi)患者能夠以親民的醫(yī)保價格,受益于國際品質(zhì)的創(chuàng)新治療方案。
02 創(chuàng)新藥“走出去”的另一條路徑
在政策環(huán)境、產(chǎn)業(yè)資本、技術(shù)進(jìn)步多重因素推動下,國產(chǎn)創(chuàng)新藥步入發(fā)展黃金期,成為一條擁有強(qiáng)大護(hù)城河的長期賽道。而隨著本土藥企創(chuàng)新能力的不斷提升,以及外資企業(yè)對本土藥企創(chuàng)新實(shí)力的逐步認(rèn)可,通過授權(quán)合作“走出去”,也逐漸成為國內(nèi)制藥領(lǐng)域常見的方式。
國內(nèi)生物制藥公司向海外公司許可(license out)項(xiàng)目的交易案例越來越多也可視為中國制藥產(chǎn)業(yè)實(shí)力大幅提升的標(biāo)志性事件之一。據(jù)醫(yī)藥魔方不完全統(tǒng)計,2017~2020年間中國生物制藥公司對外license out的案例已經(jīng)有39起,這個數(shù)字是2006~2016這10年之間發(fā)生license out交易案例數(shù)的3倍。
從首付款TOP10的創(chuàng)新藥交易來看,除復(fù)宏漢霖的曲妥珠單抗生物類似藥之外,其余l(xiāng)icense out項(xiàng)目主要是創(chuàng)新單克隆抗體項(xiàng)目和細(xì)胞療法,受讓方中則不乏強(qiáng)生、諾華、禮來這樣的跨國巨頭。
中國藥企對外項(xiàng)目許可TOP10(按首付款)

從交易總額TOP10的創(chuàng)新藥交易來看,百濟(jì)神州、天境生物與跨國藥企之間的交易在不斷刷新紀(jì)錄。位居首位的是,百濟(jì)神州與全球制藥巨頭諾華今年1月就替雷利珠單抗在多個國家的開發(fā)、生產(chǎn)與商業(yè)化達(dá)成合作與授權(quán)協(xié)議,預(yù)付款為6.5億美元,里程碑付款為15.5億美元,總交易金額超過22億美元。
百濟(jì)神州總裁吳曉濱博士曾在采訪中介紹,百濟(jì)與諾華的合作,不僅代表了國際制藥巨頭對于國內(nèi)創(chuàng)新藥品質(zhì)的認(rèn)可,也為PD-1的全球化,以及長期在聯(lián)合療法中的探索,帶來了更廣闊的可能性。據(jù)百濟(jì)神州2020年財報披露,替雷利珠單抗將計劃在2021年遞交首個在海外市場的新藥上市申請。
中國藥企對外項(xiàng)目許可TOP10(按交易總額)

本土藥企與跨國巨頭的合作,既彰顯了本土創(chuàng)新藥企業(yè)的綜合實(shí)力,也有利于加速國產(chǎn)創(chuàng)新藥“出海”,服務(wù)全球更多的患者。從跨境交易趨勢來看,中外醫(yī)藥公司強(qiáng)強(qiáng)聯(lián)合,共同開發(fā)國內(nèi)、國際醫(yī)藥市場或?qū)⒊蔀槌B(tài)。
03 中國新藥出海,不僅僅是發(fā)達(dá)國家
中國藥企的國際化、全球化應(yīng)該是大勢所趨。不過需要認(rèn)清的是,若想?yún)⑴c全球的創(chuàng)新藥開發(fā)競爭,尤其是美、歐、日等成熟市場的競爭,中國企業(yè)在營業(yè)收入、研發(fā)投入的體量上仍與世界巨頭之間存在較大差距。
不過從另外一個角度來看,全球TOP10藥企的營業(yè)收入絕大部分是來自于總?cè)丝诓坏?0%的歐美日韓等發(fā)達(dá)國家,來自中國等新興市場的收入依舊占比較低,這主要也是因?yàn)橹挥薪?jīng)濟(jì)發(fā)達(dá)的國家才能容納創(chuàng)新藥相對較高的價格體系。
隨著中國醫(yī)藥研發(fā)實(shí)力的不斷增強(qiáng),諸多本土藥企積極布局創(chuàng)新藥的國際化,未來還將會有更多的國產(chǎn)創(chuàng)新藥尋求“出海”。除了進(jìn)軍美國、歐洲成熟市場外,利用研發(fā)成本的優(yōu)勢去滿足欠發(fā)達(dá)國家的患者需求也是一個比較值得挖掘的差異化市場機(jī)會。
如何以高質(zhì)量造福歐美日韓發(fā)達(dá)國家之外的全球80%國家患者?澤布替尼在全球五大洲40多個國家的布局策略,廣泛覆蓋了包括阿聯(lián)酋、以色列、土耳其以及拉丁美洲和加勒比海、中東和北非地區(qū)的多個發(fā)展中國家,這也或許為產(chǎn)業(yè)發(fā)展指示了一個方向:獲得FDA認(rèn)可不是產(chǎn)品開發(fā)的終點(diǎn),而是其進(jìn)入全球其他國家的起點(diǎn),其后續(xù)的商業(yè)化之路任重而道遠(yuǎn)。



